
Emai:marketing@gdrzzg.com
业务咨询专线:400-780-8018
Tel: +1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email: marketing@medicilon.com
地址:上海市浦东新区川大路585号
邮编:201299
电话:+86 (21) 5859-1500(总机)
传真:+86 (21) 5859-6369






© 2023 上海合乐HL8生物医药股份有限公司 保留所有权利 沪ICP备10216606号-3
沪公网安备 31011502018888号 | 网站地图


业务咨询
中国:
Email: marketing@gdrzzg.com
业务咨询专线:400-780-8018
(仅限服务咨询,其他事宜请拨打川沙总部电话)
川沙总部电话: +86 (21) 5859-1500
海外:
+1(626)986-9880(U.S. - West Coast)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com




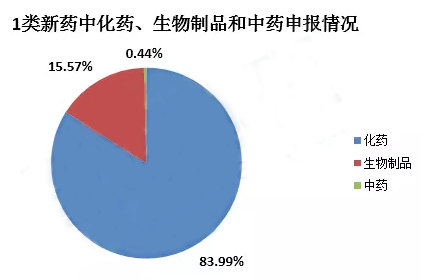
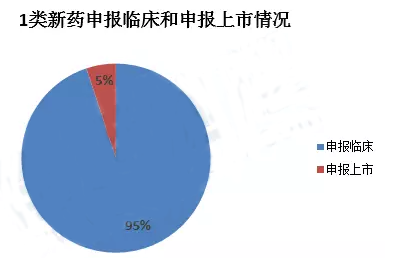
申报临床的为433件,其中LCAR-B38MCAR-T细胞自体回输制剂是我国首个受理的CAR-T类药物。申报上市的为23件,其中重组埃博拉病毒病疫苗已获批上市,信迪单抗注射液是首个申请上市的国产PD-1单抗。



 相关新闻
相关新闻